İşte Cevaplar
Cevap : Kimyasal Tür Nedir?
Bir maddenin bütün özelliklerini taşıyan yapı taşlarına kimyasal tür denir. Dört çeşit kimyasal tür vardır: atom, molekül, iyon, radikal.
Atom
Bir elementin fiziksel ve kimyasal özelliklerini gösteren en küçük birimine atom denir.
Molekül
Aynı cins veya farklı cins bir kaç atomun bir araya gelmesiyle oluşan yapılara molekül denir.
İyon
Elektron sayısı proton sayısına eşit olmayan yapılara iyon denir.
Radikal
Oktedini tamamlamamış bir ya da birden fazla ortaklaşmamış elektron çifti içeren yüksek enerjili ve kararsız yapılardır.
Kimyasal Türler Arası Etkileşimin Sınıflandırılması
Kimyasal türler arasında meydana gelen etkileşimler güçlü etkileşimler ve zayıf etkileşimler şeklinde ikiye ayrılır.
Güçlü Etkileşimler
Kimyasal türler arasındaki itme ve çekme kuvvetleri aynı anda gerçekleşir. Çekme kuvvetleri itme kuvvetlerinden çok fazla olduğunda türler arasında bir kimyasal bağ oluşur. Kimyasal türler arasında kimyasal bağ oluşmasına neden olan bu tür etkileşimler güçlü etkileşimler olarak da adlandırılır.
Güçlü etkileşimler,
İyonik Bağ
Elektron alışverişi gerçekleştirerek oluşan bağlara iyonik bağ denir. İyonik bağın oluşmasını, atomların elektron çekme isteğinin (elektronegativite) farklı olması sağlar. Elektron çekme isteği daha fazla olan atomun elektron sayısı proton sayısını geçer ve böylece bileşiğin anyon kısmını, elektron veren kısım ise bileşiğin katyon kısmını oluşturur. Örneğin günlük hayatta sıklıkla kullandığımız sofra tuzu (NaCl) bileşiği iyonik bir bileşiktir ve bileşikte sodyum (Na) katyon (Na+), klor (Cl) anyondur (Cl–).
İki atom arasında, bir veya daha fazla elektronun paylaşılmasıyla karakterize edilen kimyasal bağın bir tanımıdır. Genellikle bağ, ortaya çıkan molekülü bir arada tutan ortak çekim gücü olarak tanımlanabilir. Paylaşılan elektron ya da elektronlar, her iki çekirdek etrafında dolanacaklar, iki çekirdek arasındaki bölgede daha uzun süre bulundukları için bu bölgede (-) yüklü bir alan oluşturacaklardır. Bu alan, her iki çekirdeğe bir çekme kuvveti uygulayarak bir bağ oluşturur. Kovalent bağ, Polar Kovalent Bağ ve Apolar Kovalent Bağ olmak üzere ikiye ayrılır.
Apolar Kovalent Bağ (Kutupsuz Kovalent Bağ): Bağı yapan atomların elektronegatiflikleri eşitse meydana gelen bağ çeşididir. Yani iki atomda elektronu aynı şiddetle çeker ve elektron üzerinde kutupsuz bir çekim meydana gelir. Aynı cins iki ametal atomunun birleşmesiyle meydana gelir. Apolar kovalent bağ örnekleri; iki oksijen atomunun elektronlarını ortaklaşa kullanarak meydana getirdikleri bağıdır.
Polar Kovalent Bağ (Kutuplu Kovalent Bağ): İki farklı cins atomun bir araya gelmesiyle oluşur. Farklı atomlar oldukları için oluşan elektronegativite farkı, atomlardan elektronegativitesi yüksek olanın kısmi negatif, diğerinin ise kısmi pozitif yüklenmesini sağlar. Örneğin suyu meydana getiren hidrojen ve oksijen moleküllerinin son orbitallerindeki elektronların ortak kullanılmasıyla polar kovalent bağ meydana gelir.
Metalik Bağ
Metalik bağ, esas olarak metaller arasındaki, bir ya da daha çok atomu bir arada tutan bir kimyasal bağ türüdür. Metal atomlarının latisindeki serbest elektronların yer değiştirmiş olarak paylaşılması esasına dayanır. Metalik bağ, kovalent bağ ve iyonik bağ ile birlikte üç güçlü etkileşimden(bağ) biridir. Kimyasal bir etkileşimdir.
Aynı periyotta sağa doğru gidildikçe metal atomları arasında, metalik bağ kuvveti artar, erime noktası yükselir.
Aynı grupta yukarı doğru gidildikçe metal atomları arasında, metalik bağ kuvveti artar, erime noktası yükselir.
Elektron denizinde serbest dolaşan değerlik elektron sayısı arttıkça metalik bağ kuvveti artar.
Metalik bağ metallerin elektrik akımını iletmesini, tel ve levha haline gelmesini ve işlenebilir olmasını sağlar.
Metaller gelen ışığı yansıttığı için parlaktır.
Oda şartlarında cıva hariç katı hâlindedirler. Cıva oda koşullarında sıvı hâldedir.
Zayıf Etkileşimler
Zayıf etkileşimler fiziksel bağlardır ve maddelerin molekülleri arasında etkilidir. Zayıf etkileşimler Van der Waals kuvvetleri ve hidrojen bağları olmak üzere ikiye ayrılır.
Van der Waals Kuvvetleri
Van der Waals kuvvetleri, hidrojen bağları dışında kalan diğer zayıf etkileşimlere verilen addır. Bu kuvvetler adını Hollandalı fizikçi Johannes Diderik van der Waals’tan (1837 -1923) almaktadır.
Üç tür Van der Waals kuvveti vardır:
Dipol-Dipol Etkileşimleri: Kalıcı dipole sahip polar kimyasal türler birbirlerine yaklaştığında birinin kısmi pozitif (δ+) ve diğerinin kısmi negatif (δ–) kutbu arasında elektrostatik çekim kuvveti oluşur. Bu çekim kuvvetine dipol – dipol bağı (kuvveti) adı verilir.
H2S, CO, HCl, NF3 gibi polar karakterli moleküller arasında polar etkileşim vardır ve molekülleri arasında dipol – dipol bağları oluşur.
İyon – Dipol Bağları: İyon ve polar bir molekül bir araya geldiğinde iyon ile polar molekülün kısmi yüklenmiş kutupları arasında etkileşim olur. Buna iyon-dipol etkileşimi denir.
Yemek tuzu (NaCl) iyon yapılı bir bileşiktir. NaCl tuzu kristali suya atıldığında H2O moleküllerinin kısmi pozitif “δ+” yüklü uçları ile Cl– iyonları arasında ve kısmi negatif “δ+” yüklü uçları ile Na+ iyonları arasında iyon – dipol bağı oluşur. Bu şekilde H2O molekülleri iyonları çevreler ve dağıtır. Böylece çözünme gerçekleşir.
London Kuvvetleri: Birbirine yaklaşan apolar moleküller ya da soy gaz atomları arasında geçici dipoller oluşur. Bu geçici dipoller arasında indüklenmiş dipol çekim kuvvetleri meydana gelir. İndüklenmiş dipol çekim kuvvetlerine “London Kuvvetleri” adı da verilir.
Hidrojen Bağları
Hidrojen bağı, bir molekül oksijen, azot veya flor gibi elektronegatif bir atoma bağlı hidrojenin kısmi artı yükle yüklenmesi sonucu, başka veya aynı moleküldeki elektronegatif atom ile yaptığı kuvvetli bağdır.

Diğer Cevaplara Gözat
Bir maddenin bütün özelliklerini taşıyan yapı taşlarına kimyasal tür denir. Dört çeşit kimyasal tür vardır: atom, molekül, iyon, radikal.
Atom
Bir elementin fiziksel ve kimyasal özelliklerini gösteren en küçük birimine atom denir.
- Atomlar fiziksel ve kimyasal yöntemlerle daha basit birimlerine ayrıştırılamaz.
- Nükleer yöntemlerle ayrıştırılabilirler.
- Proton, nötron gibi tanecikler çekirdekte; elektronlar ise elektron bulutunda yer alır.
- Atomlar boyutlarının çok küçük olması nedeniyle optik mikroskoplarla görüntülenemez ancak elektron mikroskobu gibi araçlarla görüntülenebilir.
Molekül
Aynı cins veya farklı cins bir kaç atomun bir araya gelmesiyle oluşan yapılara molekül denir.
- En küçük molekülü iki atomludur.
- Aynı tür atomların bir araya gelmesi sonucu element molekülü, farklı tür atomların bir araya gelmesiyle bileşik molekülü oluşur.
- Bileşikler kimyasal yöntemlerle kendini oluşturan bileşenlere ayrışabilir.
- Moleküller iki atomlu (diatomik), üç atomlu (triatomik) veya çok atomlu (poliatomik) olabilir.
İyon
Elektron sayısı proton sayısına eşit olmayan yapılara iyon denir.
- Bir atom, elektron verdiğinde verdiği elektron sayısı kadar pozitif (+), Pozitif yüklü iyonlara katyon denir.
- Elektron aldığında aldığı elektron sayısı kadar negatif (-) yükle yüklenir. Negatif yüklü iyonlara anyon denir.
- Birden fazla atomun tek bir atom gibi davrandığı yüklü atom gruplarına kök adı verilir.
- Bir atom elektron verip katyonuna dönüştüğünde çapı küçülür.
- Elektron alıp anyonuna dönüştüğünde ise çapı büyür.
Radikal
Oktedini tamamlamamış bir ya da birden fazla ortaklaşmamış elektron çifti içeren yüksek enerjili ve kararsız yapılardır.
- Radikaller zincirleme reaksiyonların gerçeklemesinde başlatıcı olarak görev yaparlar.
- İnsan vücudunda radikaller kendiliğinden oluşabilir ve vücuda zarar verebilirler.
Kimyasal Türler Arası Etkileşimin Sınıflandırılması
Kimyasal türler arasında meydana gelen etkileşimler güçlü etkileşimler ve zayıf etkileşimler şeklinde ikiye ayrılır.
Güçlü Etkileşimler
Kimyasal türler arasındaki itme ve çekme kuvvetleri aynı anda gerçekleşir. Çekme kuvvetleri itme kuvvetlerinden çok fazla olduğunda türler arasında bir kimyasal bağ oluşur. Kimyasal türler arasında kimyasal bağ oluşmasına neden olan bu tür etkileşimler güçlü etkileşimler olarak da adlandırılır.
Güçlü etkileşimler,
- İyonik bağ
- Kovalent bağ
- Metalik bağ
İyonik Bağ
Elektron alışverişi gerçekleştirerek oluşan bağlara iyonik bağ denir. İyonik bağın oluşmasını, atomların elektron çekme isteğinin (elektronegativite) farklı olması sağlar. Elektron çekme isteği daha fazla olan atomun elektron sayısı proton sayısını geçer ve böylece bileşiğin anyon kısmını, elektron veren kısım ise bileşiğin katyon kısmını oluşturur. Örneğin günlük hayatta sıklıkla kullandığımız sofra tuzu (NaCl) bileşiği iyonik bir bileşiktir ve bileşikte sodyum (Na) katyon (Na+), klor (Cl) anyondur (Cl–).
- İyonik bağlarda zıt yükler birbirini çektiği için diğer güçlü bağlardan genellikle daha sağlamdır. Bundan dolayı erime – kaynama sıcaklıkları yüksektir.
- İyonik bağda bulunan metaller katyonları, ametaller anyonları oluşturur.
- İyonik bileşiklerin katı halleri sert ve kırılgandır. İyonik katı üzerine çekiçle vurulduğunda iyonik kristalin düzenli yapısı bozulur ve kırılma olayı gerçekleşir. Fiziksel özellik bakımından seramiklere benzerler.
- İyonik bağlı katılarda iyonlar hareket etmediği için elektrik akımını iletmezler.
- İyonik katılar suda çözündüğünde elektrik akımını iletir. Örneğin tuzlu su.
İki atom arasında, bir veya daha fazla elektronun paylaşılmasıyla karakterize edilen kimyasal bağın bir tanımıdır. Genellikle bağ, ortaya çıkan molekülü bir arada tutan ortak çekim gücü olarak tanımlanabilir. Paylaşılan elektron ya da elektronlar, her iki çekirdek etrafında dolanacaklar, iki çekirdek arasındaki bölgede daha uzun süre bulundukları için bu bölgede (-) yüklü bir alan oluşturacaklardır. Bu alan, her iki çekirdeğe bir çekme kuvveti uygulayarak bir bağ oluşturur. Kovalent bağ, Polar Kovalent Bağ ve Apolar Kovalent Bağ olmak üzere ikiye ayrılır.
Apolar Kovalent Bağ (Kutupsuz Kovalent Bağ): Bağı yapan atomların elektronegatiflikleri eşitse meydana gelen bağ çeşididir. Yani iki atomda elektronu aynı şiddetle çeker ve elektron üzerinde kutupsuz bir çekim meydana gelir. Aynı cins iki ametal atomunun birleşmesiyle meydana gelir. Apolar kovalent bağ örnekleri; iki oksijen atomunun elektronlarını ortaklaşa kullanarak meydana getirdikleri bağıdır.
Polar Kovalent Bağ (Kutuplu Kovalent Bağ): İki farklı cins atomun bir araya gelmesiyle oluşur. Farklı atomlar oldukları için oluşan elektronegativite farkı, atomlardan elektronegativitesi yüksek olanın kısmi negatif, diğerinin ise kısmi pozitif yüklenmesini sağlar. Örneğin suyu meydana getiren hidrojen ve oksijen moleküllerinin son orbitallerindeki elektronların ortak kullanılmasıyla polar kovalent bağ meydana gelir.
Metalik Bağ
Metalik bağ, esas olarak metaller arasındaki, bir ya da daha çok atomu bir arada tutan bir kimyasal bağ türüdür. Metal atomlarının latisindeki serbest elektronların yer değiştirmiş olarak paylaşılması esasına dayanır. Metalik bağ, kovalent bağ ve iyonik bağ ile birlikte üç güçlü etkileşimden(bağ) biridir. Kimyasal bir etkileşimdir.
Aynı periyotta sağa doğru gidildikçe metal atomları arasında, metalik bağ kuvveti artar, erime noktası yükselir.
Aynı grupta yukarı doğru gidildikçe metal atomları arasında, metalik bağ kuvveti artar, erime noktası yükselir.
Elektron denizinde serbest dolaşan değerlik elektron sayısı arttıkça metalik bağ kuvveti artar.
Metalik bağ metallerin elektrik akımını iletmesini, tel ve levha haline gelmesini ve işlenebilir olmasını sağlar.
Metaller gelen ışığı yansıttığı için parlaktır.
Oda şartlarında cıva hariç katı hâlindedirler. Cıva oda koşullarında sıvı hâldedir.
Zayıf Etkileşimler
Zayıf etkileşimler fiziksel bağlardır ve maddelerin molekülleri arasında etkilidir. Zayıf etkileşimler Van der Waals kuvvetleri ve hidrojen bağları olmak üzere ikiye ayrılır.
Van der Waals Kuvvetleri
Van der Waals kuvvetleri, hidrojen bağları dışında kalan diğer zayıf etkileşimlere verilen addır. Bu kuvvetler adını Hollandalı fizikçi Johannes Diderik van der Waals’tan (1837 -1923) almaktadır.
Üç tür Van der Waals kuvveti vardır:
- Polar moleküller arasında meydana gelen dipol-dipol etkileşimleri
- Polar moleküller ve iyonlar arasında meydana gelen iyon-dipol etkileşimleri
- Apolar moleküller arasında meydana gelen London kuvvetleri
Dipol-Dipol Etkileşimleri: Kalıcı dipole sahip polar kimyasal türler birbirlerine yaklaştığında birinin kısmi pozitif (δ+) ve diğerinin kısmi negatif (δ–) kutbu arasında elektrostatik çekim kuvveti oluşur. Bu çekim kuvvetine dipol – dipol bağı (kuvveti) adı verilir.
H2S, CO, HCl, NF3 gibi polar karakterli moleküller arasında polar etkileşim vardır ve molekülleri arasında dipol – dipol bağları oluşur.
- Atomlar arasındaki; elektronegatiflik farkı arttıkçadipol-dipol bağlarının kuvveti artar.
- Dipol-dipol kuvveti arttıkça atomlar arasındaki bağı kırmak zorlaşır ve böylece maddenin erime ve kaynama sıcaklığı daha yüksek olur.
- Polar (dipol) yapıya sahip moleküller birbiri içinde çözünebilir.
İyon – Dipol Bağları: İyon ve polar bir molekül bir araya geldiğinde iyon ile polar molekülün kısmi yüklenmiş kutupları arasında etkileşim olur. Buna iyon-dipol etkileşimi denir.
Yemek tuzu (NaCl) iyon yapılı bir bileşiktir. NaCl tuzu kristali suya atıldığında H2O moleküllerinin kısmi pozitif “δ+” yüklü uçları ile Cl– iyonları arasında ve kısmi negatif “δ+” yüklü uçları ile Na+ iyonları arasında iyon – dipol bağı oluşur. Bu şekilde H2O molekülleri iyonları çevreler ve dağıtır. Böylece çözünme gerçekleşir.
London Kuvvetleri: Birbirine yaklaşan apolar moleküller ya da soy gaz atomları arasında geçici dipoller oluşur. Bu geçici dipoller arasında indüklenmiş dipol çekim kuvvetleri meydana gelir. İndüklenmiş dipol çekim kuvvetlerine “London Kuvvetleri” adı da verilir.
- Anlık sürelerde gerçekleştiği için London kuvvetleri moleküller arası etkileşimlerin en zayıfı olarak kabul edilir.
- Soy gazlarda ve halojenlerde atomlar veya moleküller arasındaki tek etkileşim london bağlarıdır.
- London kuvvetleri elektron hareketliliğine bağlı olduğu için elektron sayısı arttıkça etkileşimler de artar.
- Dipol-dipol bağlarının oluştuğu ortamlarda da london bağlarına rastlanır. Ancak london bağı yok sayılabilecek kadar etkisiz olduğu için hesaplamaya katılmaz (bazı kovalent maddelerde london bağları ihmal edilemeyecek kadar yüksek olur.
Hidrojen Bağları
Hidrojen bağı, bir molekül oksijen, azot veya flor gibi elektronegatif bir atoma bağlı hidrojenin kısmi artı yükle yüklenmesi sonucu, başka veya aynı moleküldeki elektronegatif atom ile yaptığı kuvvetli bağdır.
- Hidrojen bağı olabilmesi için molekülde kesinlikle H-O, H-N veya H-F bağları olmak zorundadır.
- Hidrojen bağı dipol-dipol ve london bağları ile kıyaslandığında, hidrojen bağları yaklaşık olarak 10 kat daha güçlüdür.
- Hidrojen bağı oluşturan maddeler birbiri içinde daha iyi çözünür. Bu yüzden etil alkol (C2H5OH) suda çok iyi çözünür.
- Bazı hidrojen bağları atomlar arasındaki kovalent bağdan daha güçlüdür. Örneğin glikoz bir kapta ısıtıldığında erimeye başlamadan önce molekül yapısı bozulur. Bu nedenle ısıtılan şeker önce karamelleşir ısıtılmaya devam edildiğinde ise kömürleşir.
- Hidrojen atomunun 1 elektronun ve 1 protonun olması, hidrojen bağının dipol-dipol bağına ek olarak elektrostatik bir kuvvetle de desteklenmesini sağlamaktadır.
- HF, H2O, NH3 bileşiklerinin kaynama noktaları, hidrojen bağları nedeni ile çok yüksektir.
- Buzun yoğunluğunun suyun yoğunluğundan az olmasının nedeni de hidrojen bağları ile açıklanmaktadır.

Diğer Cevaplara Gözat
Cevap :
Bulmacada 'Kimyasal türler arası etkileşim' sorusunun cevabı olan 'İYONİK BAĞ - KOVALENT BAĞ -METALİK BAĞ - HİDROJEN - KİMYASAL ETKİLEŞİM - ATOM -İYON - MOLEKÜL' kelimesinin sözlükte eş anlamı nedir:
HİDROJEN kelimesinin Eş Anlamlıları:
HİDROJEN kelimesinin Eş Anlamlıları:
- Müvellidülma (12 harfli)
- Öğecik (6 harfli)
- Yükün (5 harfli)
- Madde (5 harfli)
Cevap :
Sözlükte İYONİK BAĞ Nedir:
İyonik Bağ (Özet) : (+) Yüklü metal atomlarıyla (-) yüklü metal atomlarının birleşmesini sağlayan bağ çeşididir. İyonik bağları (+) ve (-) iyon grupları birbirini çekerek oluştururlar. İyonik bağ etkisiyle iyonik tuzlar oluşur.
İyonik Bağ (Detay) : (+) ve (–) yüklü taneciklerin (iyonların) arasında elektriksel çekim kuvvetiyle oluşan bağa iyonik bağ denir. İyonik bağ yapan atomlardan elektron veren (+) yüklü, elektron alan (–) yüklü iyon olur. Yemek tuzu, sodyum ve klor atomlarının iyonik bağ yapmasıyla oluşur. Atom numarası 11 olan sodyum (Na), atom numarası 17 olan klor’a (Cl) 1 elektron verir. Her ikisi de kararlı hale gelir. Aralarında iyonik bağ oluşur.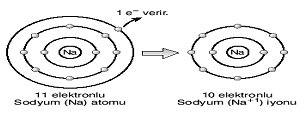 17 elektronlu klor atomu 1 e– alarak kararlı yapıya geçer.
17 elektronlu klor atomu 1 e– alarak kararlı yapıya geçer.
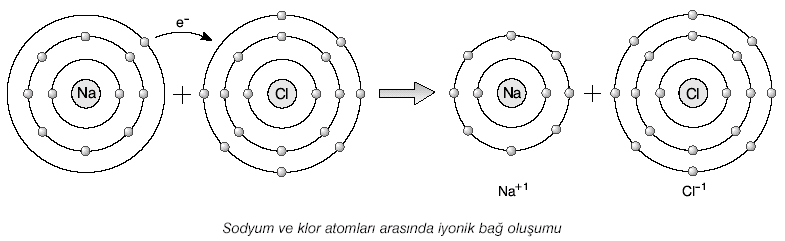 Sodyum ve klor atomları, arasında iyonik bağ yaparak NaCl bileşiğini oluşturur.
Na + Cl Na+1 + Cl–1 NaCl
İyonik bağ yaparak oluşan maddelere iyonik yapılı maddeler denir. Bir Metal ile bir ametal iyonik bileşik oluşturur.
İyonik bileşikler oda şartlarında genellikle katı hâlde ve kristal yapıda bulunur.
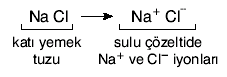
Sert ve kırılgan bir özelliğe sahiptir. İyonik kristaller katı hâlde elektrik akımını iletmez fakat sulu çözeltilerinde iyonlarına ayrışır ve elektrik akımını iletir.
Yemek tuzu iyonik bağlı bir bileşiktir ve kristal yapıdadır.
Sodyum ve klor atomları, arasında iyonik bağ yaparak NaCl bileşiğini oluşturur.
Na + Cl Na+1 + Cl–1 NaCl
İyonik bağ yaparak oluşan maddelere iyonik yapılı maddeler denir. Bir Metal ile bir ametal iyonik bileşik oluşturur.
İyonik bileşikler oda şartlarında genellikle katı hâlde ve kristal yapıda bulunur.
Sert ve kırılgan bir özelliğe sahiptir. İyonik kristaller katı hâlde elektrik akımını iletmez fakat sulu çözeltilerinde iyonlarına ayrışır ve elektrik akımını iletir.
Yemek tuzu iyonik bağlı bir bileşiktir ve kristal yapıdadır.
İyonik Bağ (Özet) : (+) Yüklü metal atomlarıyla (-) yüklü metal atomlarının birleşmesini sağlayan bağ çeşididir. İyonik bağları (+) ve (-) iyon grupları birbirini çekerek oluştururlar. İyonik bağ etkisiyle iyonik tuzlar oluşur.
İyonik Bağ (Detay) : (+) ve (–) yüklü taneciklerin (iyonların) arasında elektriksel çekim kuvvetiyle oluşan bağa iyonik bağ denir. İyonik bağ yapan atomlardan elektron veren (+) yüklü, elektron alan (–) yüklü iyon olur. Yemek tuzu, sodyum ve klor atomlarının iyonik bağ yapmasıyla oluşur. Atom numarası 11 olan sodyum (Na), atom numarası 17 olan klor’a (Cl) 1 elektron verir. Her ikisi de kararlı hale gelir. Aralarında iyonik bağ oluşur.
Sodyumun (Na) Na+ iyonuna dönüşmesi:
11 elektronlu sodyum atomu 1 elektron vererek kararlı hale gelir. 17 elektronlu klor atomu 1 e– alarak kararlı yapıya geçer.
17 elektronlu klor atomu 1 e– alarak kararlı yapıya geçer.
 Sodyum ve klor atomları, arasında iyonik bağ yaparak NaCl bileşiğini oluşturur.
Na + Cl Na+1 + Cl–1 NaCl
İyonik bağ yaparak oluşan maddelere iyonik yapılı maddeler denir. Bir Metal ile bir ametal iyonik bileşik oluşturur.
İyonik bileşikler oda şartlarında genellikle katı hâlde ve kristal yapıda bulunur.
Sert ve kırılgan bir özelliğe sahiptir. İyonik kristaller katı hâlde elektrik akımını iletmez fakat sulu çözeltilerinde iyonlarına ayrışır ve elektrik akımını iletir.
Yemek tuzu iyonik bağlı bir bileşiktir ve kristal yapıdadır.
Sodyum ve klor atomları, arasında iyonik bağ yaparak NaCl bileşiğini oluşturur.
Na + Cl Na+1 + Cl–1 NaCl
İyonik bağ yaparak oluşan maddelere iyonik yapılı maddeler denir. Bir Metal ile bir ametal iyonik bileşik oluşturur.
İyonik bileşikler oda şartlarında genellikle katı hâlde ve kristal yapıda bulunur.
Sert ve kırılgan bir özelliğe sahiptir. İyonik kristaller katı hâlde elektrik akımını iletmez fakat sulu çözeltilerinde iyonlarına ayrışır ve elektrik akımını iletir.
Yemek tuzu iyonik bağlı bir bileşiktir ve kristal yapıdadır.

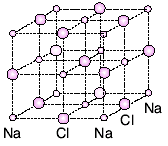
İyonik Bağlı Bileşiklerde Kristal Yapı
İyonik bağlı bileşiklerde iyonlar birbirini en kuvvetli şekilde çekecek bir düzen içinde dizilirler. Böyle düzenli birleşen atomlardan kristal yapı adını verdiğimiz düzgün geometrik şekiller oluşur. Yemek tuzunun kristal yapısı buna örnektir. Yemek tuzundaki (NaCl) kristal yapı, şekildeki gibidir.
İyonik bağlı bileşiklerin özellikleri
1.İyonik bileşikleri oluşturan iyonlar belli bir geometrik düzen içinde dizilirler, bu yapıya iyonik kristal yapı denir. 2.İyonik bileşikler oda sıcaklığında genellikle katı halde ve kristal yapıda bulunur. 3.İyonik bağlı bileşikler elektrik akımını iletmezler. 4.Sulu çözeltilerinde ve erimiş halde iyonlarına ayrıştıkları için bu hallerde elektrik akımını iletirler. 5.Sert ve kırılgandırlar, tel ve levha haline getirilemezler, herhangi bir zorlamada kırılırlar. 6.İyonik bileşiklerin formüllünü yazarkenİyonik ve kovalent bileşikler arasındaki farklar
İyonik bir bağ durumunda atomlar, zıt yüklü iyonların çekimi ile birbirine bağlı iken, kovalent bağ durumunda atomlar, elektron paylaşımı yoluyla bağlanırlar. Kovalent bağ durumunda, her atomun etrafındaki moleküler geometri, VSEPR kuralları[1] ile belirlenirken, iyonik malzemelerde geometri, maksimum sıkıpaket kurallarını takip eder. Dolayısıyla bir bileşiğin iyonik ya da kovalent olarak sınıflandırılması vardır.
Cevap :
Sözlükte KOVALENT BAĞ Nedir:
Kovalent Bağ (Özet) : Atomlar arasında, son katmanlarda yer alan elektronlardan bazılarının ortaklaşa kullanılmasıyla oluşan bağa Kovalent Bağ denir. Kovalent bağ, iki atom arasında, bir veya daha fazla elektronun paylaşılmasıyla karakterize edilen kimyasal bağın bir tanımıdır. Genellikle bağ, ortaya çıkan molekülü bir arada tutan ortak çekim gücü olarak tanımlanabilir. Paylaşılan elektron ya da elektronlar, her iki çekirdek etrafında dolanacaklar, iki çekirdek arasındaki bölgede daha uzun süre bulundukları için bu bölgede (-) yüklü bir alan yaratacaklardır. Bu alan, her iki çekirdeğe bir çekme kuvveti uygulayarak bir bağ yaratır.
Kovalent Bağ (Detay) : Ametal atomları kararlı yapıya ulaşmak için son yörüngedeki bazı elektronlarını ortaklaşa kullanırlar. Atomlar arasında elektronların ortaklaşa kullanılmasıyla oluşan bağa kovalent bağ denir. Örneğin iki hidrojen atomu elektronlarını ortaklaşa kullanarak aralarında kovalent bağ oluşturur. Böylece her bir hidrojen atomu helyumun kararlı yapısına ulaşır.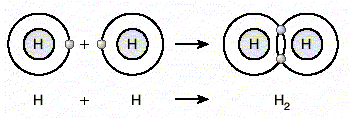 Hidrojen gibi birçok ametal başka ametallerle bileşik oluştururlar. CO, H2O, NO2, CO2 bunlardan bazılarıdır.
Kovalent bağ kuran atomlar arasında ortaklaşa kullanılan elektronlar, her iki atomu da dublet ya da oktete ulaştırır. Her iki atoma da iyon diyemeyiz. Çünkü elektron almamış, vermemişlerdir. Kovalent bağ aynı cins atomlar arasında oluyorsa apolar kovalent bağ adını alır.
Kovalent bağ farklı cins atomlar arasında oluyorsa polar kovalent bağ adını alır. Su molekülünün bağ yapısı bir su molekülü iki hidrojen ve bir oksijen atomunun kovalent bağ yapması sonucu oluşur. Hidrojen atomlarından her biri kendi elektronunu oksijen atomunun bir elektronu ile ortaklaşa kullanır. Böylece hidrojen atomları kararlı helyuma benzerken, oksijen atomu da kararlı neona benzer.
Hidrojen gibi birçok ametal başka ametallerle bileşik oluştururlar. CO, H2O, NO2, CO2 bunlardan bazılarıdır.
Kovalent bağ kuran atomlar arasında ortaklaşa kullanılan elektronlar, her iki atomu da dublet ya da oktete ulaştırır. Her iki atoma da iyon diyemeyiz. Çünkü elektron almamış, vermemişlerdir. Kovalent bağ aynı cins atomlar arasında oluyorsa apolar kovalent bağ adını alır.
Kovalent bağ farklı cins atomlar arasında oluyorsa polar kovalent bağ adını alır. Su molekülünün bağ yapısı bir su molekülü iki hidrojen ve bir oksijen atomunun kovalent bağ yapması sonucu oluşur. Hidrojen atomlarından her biri kendi elektronunu oksijen atomunun bir elektronu ile ortaklaşa kullanır. Böylece hidrojen atomları kararlı helyuma benzerken, oksijen atomu da kararlı neona benzer.
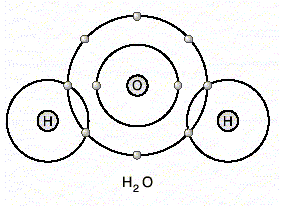 Bir su molekülü 2 hidrojen ve 1 oksijen atomundan oluştuğu için, su molekülü H2O şeklinde yazılır.
Kovalent bağlı yapılar molekül oluşturur. Atomlar arasında elektron ortaklaşması veya elektron alışverişi olmazsa kimyasal bağ da olmaz.
Kovalent bağ (iyonik ve metalik bağın tersine) yönlüdür; bağ açılarının etkileşimin gücü üzerinde etkisi büyüktür. Bu etkinin kaynağı, kovalent bağların, atomik yörüngelerin üst üste binmesiyle oluşmasından ileri gelir. Atomik yörüngeler (p, d, ve f orbitalleri) hepsi yönlü karakterde olup, bağlanma esnasında önemli ölçüde yöne bağlı etkileşime neden olurlar.
Kovalent bağ, genellikle benzer elektronegatifliğe sahip atomlar arasında gerçekleşir. Bu nedenle ametaller, daha kolaylıkla kovalent bağı tercih eder ve metaller de kolayca yerlerinden oynatılabilen elektronların daha serbestçe dolaşabildiği metalik bağ yaparlar. Ametallerde bir elektronun serbest kalması daha zordur, dolayısıyla benzer elektronegatifliğe sahip bir madde ile birleşme söz konusu olduğunda o elektronun paylaşılması tek seçenek haline gelir.
Bir su molekülü 2 hidrojen ve 1 oksijen atomundan oluştuğu için, su molekülü H2O şeklinde yazılır.
Kovalent bağlı yapılar molekül oluşturur. Atomlar arasında elektron ortaklaşması veya elektron alışverişi olmazsa kimyasal bağ da olmaz.
Kovalent bağ (iyonik ve metalik bağın tersine) yönlüdür; bağ açılarının etkileşimin gücü üzerinde etkisi büyüktür. Bu etkinin kaynağı, kovalent bağların, atomik yörüngelerin üst üste binmesiyle oluşmasından ileri gelir. Atomik yörüngeler (p, d, ve f orbitalleri) hepsi yönlü karakterde olup, bağlanma esnasında önemli ölçüde yöne bağlı etkileşime neden olurlar.
Kovalent bağ, genellikle benzer elektronegatifliğe sahip atomlar arasında gerçekleşir. Bu nedenle ametaller, daha kolaylıkla kovalent bağı tercih eder ve metaller de kolayca yerlerinden oynatılabilen elektronların daha serbestçe dolaşabildiği metalik bağ yaparlar. Ametallerde bir elektronun serbest kalması daha zordur, dolayısıyla benzer elektronegatifliğe sahip bir madde ile birleşme söz konusu olduğunda o elektronun paylaşılması tek seçenek haline gelir.
Kovalent Bağ (Özet) : Atomlar arasında, son katmanlarda yer alan elektronlardan bazılarının ortaklaşa kullanılmasıyla oluşan bağa Kovalent Bağ denir. Kovalent bağ, iki atom arasında, bir veya daha fazla elektronun paylaşılmasıyla karakterize edilen kimyasal bağın bir tanımıdır. Genellikle bağ, ortaya çıkan molekülü bir arada tutan ortak çekim gücü olarak tanımlanabilir. Paylaşılan elektron ya da elektronlar, her iki çekirdek etrafında dolanacaklar, iki çekirdek arasındaki bölgede daha uzun süre bulundukları için bu bölgede (-) yüklü bir alan yaratacaklardır. Bu alan, her iki çekirdeğe bir çekme kuvveti uygulayarak bir bağ yaratır.
Kovalent Bağ (Detay) : Ametal atomları kararlı yapıya ulaşmak için son yörüngedeki bazı elektronlarını ortaklaşa kullanırlar. Atomlar arasında elektronların ortaklaşa kullanılmasıyla oluşan bağa kovalent bağ denir. Örneğin iki hidrojen atomu elektronlarını ortaklaşa kullanarak aralarında kovalent bağ oluşturur. Böylece her bir hidrojen atomu helyumun kararlı yapısına ulaşır.
 Hidrojen gibi birçok ametal başka ametallerle bileşik oluştururlar. CO, H2O, NO2, CO2 bunlardan bazılarıdır.
Kovalent bağ kuran atomlar arasında ortaklaşa kullanılan elektronlar, her iki atomu da dublet ya da oktete ulaştırır. Her iki atoma da iyon diyemeyiz. Çünkü elektron almamış, vermemişlerdir. Kovalent bağ aynı cins atomlar arasında oluyorsa apolar kovalent bağ adını alır.
Kovalent bağ farklı cins atomlar arasında oluyorsa polar kovalent bağ adını alır. Su molekülünün bağ yapısı bir su molekülü iki hidrojen ve bir oksijen atomunun kovalent bağ yapması sonucu oluşur. Hidrojen atomlarından her biri kendi elektronunu oksijen atomunun bir elektronu ile ortaklaşa kullanır. Böylece hidrojen atomları kararlı helyuma benzerken, oksijen atomu da kararlı neona benzer.
Hidrojen gibi birçok ametal başka ametallerle bileşik oluştururlar. CO, H2O, NO2, CO2 bunlardan bazılarıdır.
Kovalent bağ kuran atomlar arasında ortaklaşa kullanılan elektronlar, her iki atomu da dublet ya da oktete ulaştırır. Her iki atoma da iyon diyemeyiz. Çünkü elektron almamış, vermemişlerdir. Kovalent bağ aynı cins atomlar arasında oluyorsa apolar kovalent bağ adını alır.
Kovalent bağ farklı cins atomlar arasında oluyorsa polar kovalent bağ adını alır. Su molekülünün bağ yapısı bir su molekülü iki hidrojen ve bir oksijen atomunun kovalent bağ yapması sonucu oluşur. Hidrojen atomlarından her biri kendi elektronunu oksijen atomunun bir elektronu ile ortaklaşa kullanır. Böylece hidrojen atomları kararlı helyuma benzerken, oksijen atomu da kararlı neona benzer.
 Bir su molekülü 2 hidrojen ve 1 oksijen atomundan oluştuğu için, su molekülü H2O şeklinde yazılır.
Kovalent bağlı yapılar molekül oluşturur. Atomlar arasında elektron ortaklaşması veya elektron alışverişi olmazsa kimyasal bağ da olmaz.
Kovalent bağ (iyonik ve metalik bağın tersine) yönlüdür; bağ açılarının etkileşimin gücü üzerinde etkisi büyüktür. Bu etkinin kaynağı, kovalent bağların, atomik yörüngelerin üst üste binmesiyle oluşmasından ileri gelir. Atomik yörüngeler (p, d, ve f orbitalleri) hepsi yönlü karakterde olup, bağlanma esnasında önemli ölçüde yöne bağlı etkileşime neden olurlar.
Kovalent bağ, genellikle benzer elektronegatifliğe sahip atomlar arasında gerçekleşir. Bu nedenle ametaller, daha kolaylıkla kovalent bağı tercih eder ve metaller de kolayca yerlerinden oynatılabilen elektronların daha serbestçe dolaşabildiği metalik bağ yaparlar. Ametallerde bir elektronun serbest kalması daha zordur, dolayısıyla benzer elektronegatifliğe sahip bir madde ile birleşme söz konusu olduğunda o elektronun paylaşılması tek seçenek haline gelir.
Bir su molekülü 2 hidrojen ve 1 oksijen atomundan oluştuğu için, su molekülü H2O şeklinde yazılır.
Kovalent bağlı yapılar molekül oluşturur. Atomlar arasında elektron ortaklaşması veya elektron alışverişi olmazsa kimyasal bağ da olmaz.
Kovalent bağ (iyonik ve metalik bağın tersine) yönlüdür; bağ açılarının etkileşimin gücü üzerinde etkisi büyüktür. Bu etkinin kaynağı, kovalent bağların, atomik yörüngelerin üst üste binmesiyle oluşmasından ileri gelir. Atomik yörüngeler (p, d, ve f orbitalleri) hepsi yönlü karakterde olup, bağlanma esnasında önemli ölçüde yöne bağlı etkileşime neden olurlar.
Kovalent bağ, genellikle benzer elektronegatifliğe sahip atomlar arasında gerçekleşir. Bu nedenle ametaller, daha kolaylıkla kovalent bağı tercih eder ve metaller de kolayca yerlerinden oynatılabilen elektronların daha serbestçe dolaşabildiği metalik bağ yaparlar. Ametallerde bir elektronun serbest kalması daha zordur, dolayısıyla benzer elektronegatifliğe sahip bir madde ile birleşme söz konusu olduğunda o elektronun paylaşılması tek seçenek haline gelir.
Cevap Yaz Arama Yap
Cevap Yaz Arama Yap
Cevap :
Sözlükte ATOM Nedir:
Atom Nedir ? (Özet) : Bir elementin tüm kimyasal özelliklerini gösteren en küçük parçasıdır.
Atom Nedir ? (Özet) : Bir elementin tüm kimyasal özelliklerini gösteren en küçük parçasıdır.
Atom Nedir ? (Detay)
Atom (Yunanca atomos, bölünemez anlamına gelir.) bir kimyasal elementin bütün özelliklerini taşıyan en küçük parçacığıdır. Gözle görülmesi imkânsız, çok küçük bir parçacıktır ve sadece taramalı tünel mikroskobu (atomik kuvvet mikroskobu) ile incelenebilir. Bir atomda, çekirdeği saran negatif yüklü bir elektron bulutu vardır. Çekirdek ise pozitif yüklü protonlar ve yüksüz nötronlardan oluşur. Atomdaki proton sayısı elektron sayısınına eşit olduğunda atom elektriksel olarak yüksüzdür. Elektron ve proton sayıları eşit değilse bu parçacık iyon olarak adlandırılır. İyonlar oldukça kararsız yapılardır ve yüksek enerjilerinden kurtulmak için ortamdaki başka iyon ve atomlarla etkileşime girerler. Bir atom, sahip olduğu proton ve nötron sayısına göre sınıflandırılır: atomdaki proton sayısı kimyasal elementi tanımlarken, nötron sayısı da bu elementin izotopunu tanımlar. Her elemetin radyoaktif bozunma veren en az bir izotopu vardır Elektronlar belirli enerji seviyelerinde bulunur ve foton salınımı veya emilimi yaparak farklı seviyeler arasında geçişlerde bulunabilirler. Elektron, elementin kimyasal özelliklerini belirlemesinin yanı sıra atomun manyetik özellikleri üzerinde de oldukça etkilidir. ATOM ve YAPISI Maddelerin gözle görülmeyen (bölünmeyen) en parçasına atom denir. Atom kendinden başka hiçbir fiziksel ya da kimyasal metotlarla kendinden farklı atomlara dönüşemezler. Atomda (+) yüklü protonalar,(-) yüklü elektronlar ve yüksüz nötronlar bulunur. Atom çekirdek ve elektron olmak üzere iki temel parçacıktan oluşur. Çekirdek:Atomun merkezini oluşturur. Hacim olarak çok küçük(1/10000) olmasına karşın tüm ağırlığın(1/1840) toplandığı kısımdır. Protonlar:Bir element için proton sayısı sabittir. Elementin tümünü ve tüm özellikleri belirleyen protondur.Proton sayısı değiştiğinde elementin türü ve tüm özelliği değişir.”p” harfiyle gösterilir. Elektron:”e” harfiyle gösterilir. Çekirdek çevresinde ,belirli yörüngelerde bulunurlar. Elektronlar bağımsız yörüngelerde bulunamazlar. ATOM MODELLERİ: DALTON ATOM MODELİ : 1- Madde, atom denilen içleri dolu bölünemeyen taneciklerden oluşmuştur. 2- Aynı elementin atomları büyüklük yönünden biribirnin aynı, farklı elementlerin atomları tamamen biribirinden farklıdır. 3- Tepkimelerde atomlar korunur. 4- Atomların birleşmeleri sonunda moleküller oluşur. THOMSON ATOM MODELi : Thomson, maddenin düzgün olarak dağıtılmış pozitif yükler ve aralarına serpiştirilmiş negatif yüklerden oluştuğunu ifade etmiştir. Bu yönüyle madde atomu üzümlü keke benzetilebilir. Kek pozitif yük, üzümler ise elektronlardır. RUTHERFORD ATOM MODELi : Merkezde kütlesi çok büyük bir çekirdek ve etrafında belirli yörüngelerde dolanan elektronlardan oluşmuştur. Bu görüşün yetersizliği ise; Elektronun neden çekirdeğe düşmediği yada atomdan fırlayıp gitmediği sorusunun cevapsız kalmasıdır. BOHR ATOM MODELi : Bohr atom modeli, elektronların çekirdekten herhangi bir uzaklıkta bulunan tek bir yörüngede değil, belirli yörüngede olduğunu belirtir. Bir elektronun bulunduğu yer elektronun sahip olduğu enerjiye bağlıdyr. Bu enerji düzeyleri çekirdeğe yakın olandan uzağa doğru 1,2,3.... gibi numaralar verilerek gösterilir. Enerji düzeylerinin enerjisi çekirdeğe yaklaştıkça azalır, uzaklaştıkça artar. Elektron bir üst enerji seviyesine enerji verilerek uyarılır ve enerji kesilirse elektron eski yerine gelir ve bu arada aldığı enerjiyi ışık şeklinde yayar. Atom Çekirdek Elektronlar Protonlar Nötronlar Atomun temel parçacıkları proton , nötron ve elektronlardır. Protonlar ve nötronlar atomun kütlesini oluşturup çekirdekte bulunurlarken, kütlesi yok denilecek kadar az olan elektronlar, çekirdeğin etrafındaki belirli yörüngelerde çok hızlı bir şekilde dönerler. Bir atomun çekirdeğindeki proton sayısı ile nötron sayısının toplamı kütle numarasını verir. Elektronun kütlesi proton ve nötronun yanında çok küçük olduğundan ihmal edilir. Kütle No= Proton Sayısı + Nötron Sayısı Atomun çekirdeğinde kaç tane pozitif yük varsa etrafında da o kadar negatif yük olmalı ki atom nötr olsun . Protonlar (+) yüklü, nötronlar yüksüz ve elektronlar (-) yüklü tanecikler olduğuna göre nötr atomlarda proton sayısı daima elektron sayısına eşit olmalıdır. Proton sayısı aynı zamanda çekirdek yükünün bir ifadesidir. Atom no=proton sayısı=elektron sayısı(nötr atomlarda)=çekirdek yükü Bir atomda kütle numarası,atom numarası ve atomun yükü aşağıdaki şekilde olduğu gibi gösterilir. İzotop Atomlar: Atom numaraları aynı kütle numaraları farklı ya da proton sayıları aynı nötron sayıları farklı olan atomlara bir birinin izotopu atomlar denir. İzotop atomların kimyasal özellikleri aynı olduğu halde fiziksel özellikleri farklıdır. İzotopu olan elementin atomik kütlesi, izotoplarının tabiattaki yüzdeleriyle doğru orantılı olarak, onların bir ortalamasıdır. Allotrop atomlar : Aynı elementin uzayda farklı şekilde dizilerek farklı geometrik şeklindeki kristallerine allotrop denir. Örneğin grafitle elmas, beyaz fosforla kırmızı fosfor, rombik kükürtle monoklinik kükürt, ozon ile oksijen birbirinin allotropudur. Allotropların fiziksel özellikleri farklı olduğu halde kimyasal özellikleri aynıdır. İzoton : Nötron sayıları eşit olan atomlara birbirinin izotonu denir. İzobar: Kütle numaraları aynı atom numaraları farklı olan atomlara izobar atomlar denir. İzoelektronik: Elektron sayıları bir birine eşit olan atomlardır.
Cevap Yaz Arama Yap
Cevap :
Sözlükte MOLEKÜL Nedir:
Molekül : Aynı ya da farklı cins atomların birleşmesiyle oluşan bileşik birimlerine molekül denir. Bileşiklerin tüm özelliklerini taşıyan en küçük birimlerine molekül adı verilir. Moleküller birden fazla atomdan oluşan bağımsız taneciklerdir.
Sözlükte molekül nedir:
» element veya birleşikleri oluşturan ve onlarin özgül niteliklerini gösteren en küçük birim, madde
» (fiziksel kimyada) bir veya birkaç atomun birleşmesinden oluşan, birkaç çekirdek veya elektronlu yapi
» bir bütünün en küçük parçası
Molekül : Aynı ya da farklı cins atomların birleşmesiyle oluşan bileşik birimlerine molekül denir. Bileşiklerin tüm özelliklerini taşıyan en küçük birimlerine molekül adı verilir. Moleküller birden fazla atomdan oluşan bağımsız taneciklerdir.
Sözlükte molekül nedir:
» element veya birleşikleri oluşturan ve onlarin özgül niteliklerini gösteren en küçük birim, madde
» (fiziksel kimyada) bir veya birkaç atomun birleşmesinden oluşan, birkaç çekirdek veya elektronlu yapi
» bir bütünün en küçük parçası
